Système d'Équilibre
Un système d'équilibre, c'est quand les choses bougent, mais au final, rien ne change vraiment. ⚖️
Introduction Brève
Imaginez une balançoire où deux personnes de même poids sont assises. Elle peut bouger, mais elle reste en équilibre. Un système d'équilibre, c'est un peu ça: des réactions se produisent, mais les quantités de chaque élément restent stables. On utilise ce concept pour comprendre comment les réactions chimiques se comportent dans des conditions spécifiques. 🧪
Explication Principale
Réactions Réversibles
La plupart des réactions chimiques ne vont pas simplement d'un point A à un point B. Elles peuvent aussi faire le chemin inverse! C'est comme un aller-retour. On appelle ça une réaction réversible. 🔄 Par exemple, imaginez que vous construisez un château de sable. Vous pouvez le construire (réaction directe), mais le vent ou la marée peuvent le détruire (réaction inverse).
Vitesse des Réactions
Au début, la réaction directe (celle qui crée quelque chose) est souvent plus rapide que la réaction inverse (celle qui le défait). Mais au fur et à mesure que la quantité de ce 'quelque chose' augmente, la réaction inverse accélère aussi. 🚀 C'est comme si plus vous avez de sable pour construire votre château, plus il y a de chances que le vent en emporte une partie.
L'Équilibre Dynamique
Finalement, les vitesses des réactions directe et inverse deviennent égales. C'est le moment d'équilibre! 🎯 Les réactions continuent de se produire, mais la quantité de chaque élément reste constante. C'est comme si le vent emportait autant de sable que vous en ajoutez au château. Il y a du mouvement, mais la taille du château ne change pas.
Perturbation de l'Équilibre
Si on change quelque chose (comme la température, la pression ou la quantité d'un élément), l'équilibre est perturbé. Le système va alors réagir pour retrouver un nouvel équilibre. 🌡️ Imaginez que quelqu'un ajoute plus de sable à votre château. Vous devrez peut-être le renforcer pour qu'il ne s'écroule pas sous le poids supplémentaire.
Exemples
- Une bouteille de soda gazeux fermée. Le dioxyde de carbone (CO2) est dissous dans le liquide, mais il y a aussi du CO2 gazeux au-dessus. Il y a un équilibre entre le CO2 dissous et le CO2 gazeux. Quand on ouvre la bouteille, on perturbe l'équilibre, et le CO2 s'échappe, créant des bulles. 🥤
- Un aquarium fermé. Les poissons respirent et produisent du CO2, tandis que les plantes absorbent le CO2 et produisent de l'oxygène. Un équilibre se crée entre la quantité de CO2 et d'oxygène. Si on met trop de poissons, on perturbe l'équilibre, et il faut ajouter plus de plantes ou changer l'eau. 🐠
- La dissolution du sucre dans l'eau. Au début, le sucre se dissout rapidement. Mais à un certain point, l'eau devient saturée, et le sucre ne se dissout plus aussi facilement. Un équilibre se crée entre le sucre dissous et le sucre non dissous. Si on ajoute plus d'eau, on perturbe l'équilibre, et plus de sucre peut se dissoudre. 🍬
Maîtrisez Toute Matière en 3 Étapes Simples
- Choisissez Votre Objectif d'Apprentissage: Sélectionnez parmi des centaines de concepts en sciences, commerce, lettres et compétences professionnelles. Décomposez des sujets complexes en parties gérables.
- Apprenez en Enseignant: Utilisez notre plateforme alimentée par l'IA pour expliquer des concepts comme si vous enseigniez à d'autres. Découvrez et comblez instantanément vos lacunes.
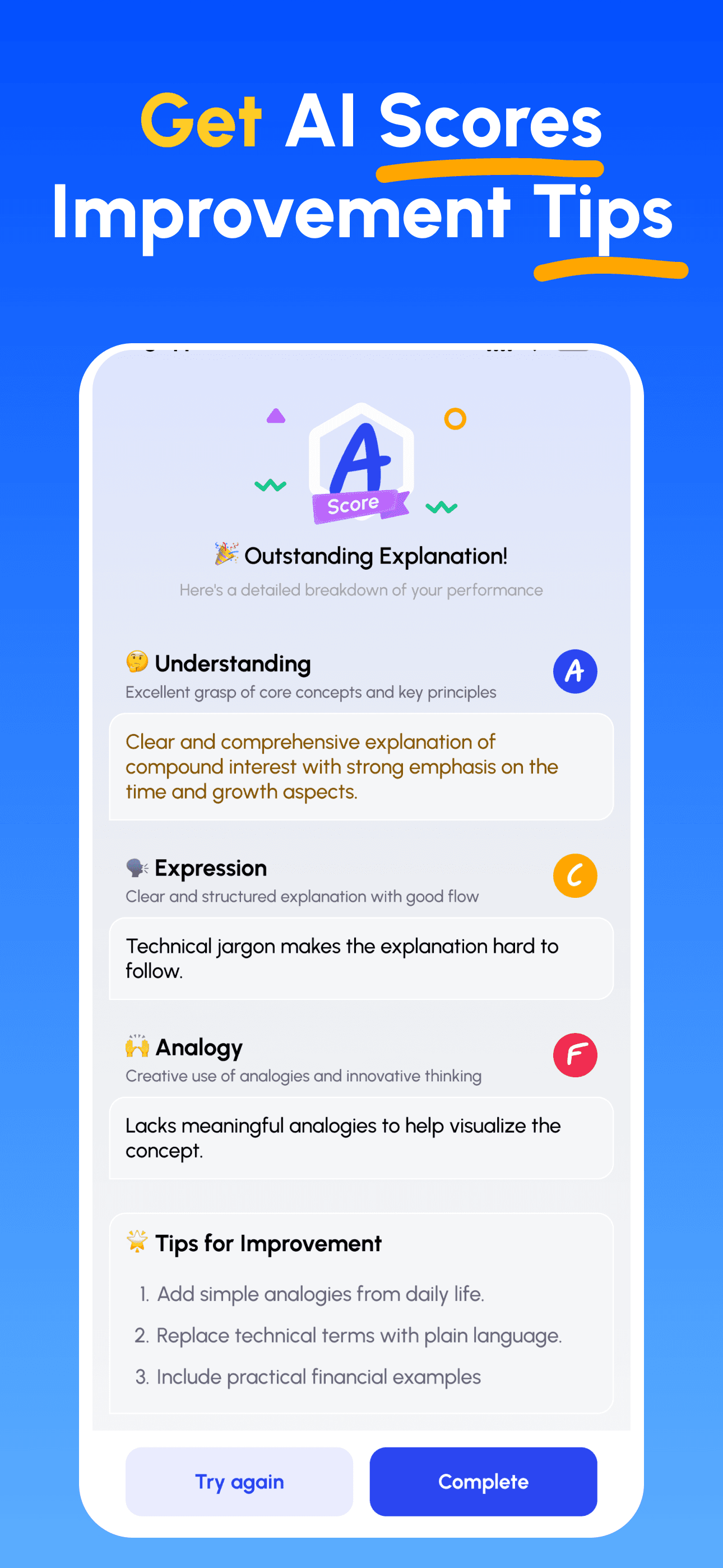
- Recevez des Conseils d'Expert par IA: Obtenez des retours immédiats et détaillés sur votre compréhension, la clarté de vos explications et vos compétences d'application pratique.
- Revoir les scores & améliorer: Suivez des conseils ciblés, affinez votre explication et itérez jusqu’à pouvoir l’enseigner simplement.
Téléchargez Feynman AI maintenant
Commencez votre parcours vers une meilleure communication dès aujourd'hui !